Un trabajo publicado en Angewandte Chemie International Edition indica que una sustitución isotópica puede suponer un cambio fundamental en el enlace químico, confirmando de paso la existencia un nuevo tipo de enlace.
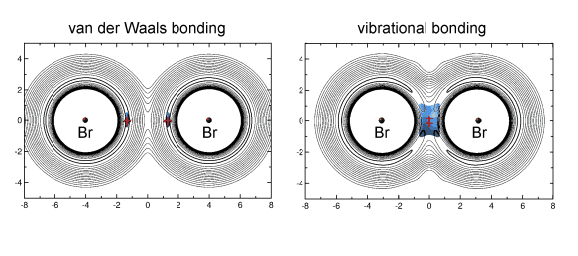
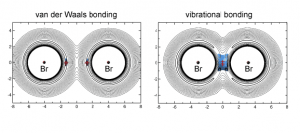
A comienzos de la década de los ochenta se propuso que en ciertos estados de transición consistentes en un átomo muy ligero entre dos más pesados el sistema se vería estabilizado, no por las fuerzas de van der Waals convencionales, sino por un nuevo tipo de enlace llamado “vibracional”, en el que el átomo ligero se desplaza entre sus dos vecinos. A pesar de que distintos grupos intentaron confirmar esta hipótesis, finalmente se aparcó por irrealizable.
Ahora, el grupo de investigadores encabezado por Donald Fleming, de la Universidad de la Columbia Británica (Canadá), cree que tiene la base teórica y las pruebas experimentales para demostrar la existencia de un enlace vibracional estable.
Los investigadores llevaron a cabo una serie de simulaciones de la reacción del bromuro de hidrógeno (BrH) con el bromo (Br) para crear el radical BrHBr. En esta estructura el H es mucho más ligero que los Br que tiene a cada lado. Para poder determinar el efecto de la sustitución isotópica se usó todo un abanico de isótopos del hidrógeno: 1H (hidrógeno “normal”, H), 2H (deuterio, D), 3H (tritio, T) y 4H (helio muónico, resultado de sustituir un electrón en el helio por un muón, una partícula con la masa de unos 200 electrones) y Mu (muonio, un átomo formado por un antimuón que actúa de núcleo y un electrón; este átomo tiene una masa 40 veces menor que la del 4H).
A la hora de comparar las distintas moléculas en función de los distintos isótopos el equipo se fijó en dos variables fundamentales: la energía potencial en la superficie de la molécula (simplificando, cuanto menor, más estable es) y un parámetro mecanocuántico, la energía del punto cero vibracional. Cuando se estudia química, y ciencia en general, se aprende que los sistemas tienden a la menor energía posible.
En el caso de una reacción química, se formarán nuevos enlaces, en principio, sólo si las moléculas resultantes son más estables que las de los reactivos, esto es, si la energía del sistema presenta una disminución neta. Desde el punto de vista clásico, esa disminución de energía neta tiene que ser de energía potencial. Sin embargo, en determinadas circunstancias, una disminución de la energía del punto cero vibracional podría ser suficiente para garantizar la estabilidad: y estaríamos ante un enlace vibracional.
Los cálculos químico-cuánticos muestran que cuando están presentes los isótopos más pesados los compuestos (BrDBr, BrTBr y Br 4H Br) se estabilizan por interacciones de van der Waals. Sin embargo en el BrMuBr se produce una disminución de la energía del punto cero vibracional que compensa el aumento de la energía potencial, con lo que existiría un enlace vibracional en este compuesto, cuya existencia ya demostró el grupo experimentalmente en un trabajo anterior.