Saponificación
Que es La Saponificacion?
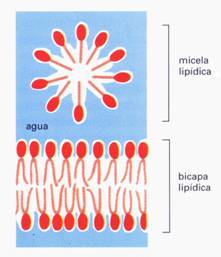
Se entiende por saponificación la reacción que produce la formación de jabones. La principal causa es la disociación de las grasas en un medio alcalino, separándose glicerina y ácidos grasos. Estos últimos se asocian inmediatamente con los álcalis constituyendo las sales sódicas de los ácidos grasos: el jabón. Esta reacción se denomina también desdoblamiento hidrolítico y es una reacción exotérmica.
La reacción típica es:
ÁCIDOS GRASOS + SOLUCIÓN ALCALINA = JABÓN + GLICERINA
 Así es como al mezclar los ácidos grasos (principales componentes de las grasas animales y de los aceites vegetales) con una solución alcalina (hecha a partir de una mezcla de agua y un álcali, como por ejemplo la sosa), se obtiene el jabón (que será realmente suave, porque además el otro subproducto que se obtiene de esta reacción es la glicerina).
Así es como al mezclar los ácidos grasos (principales componentes de las grasas animales y de los aceites vegetales) con una solución alcalina (hecha a partir de una mezcla de agua y un álcali, como por ejemplo la sosa), se obtiene el jabón (que será realmente suave, porque además el otro subproducto que se obtiene de esta reacción es la glicerina).
El álcali es imprescindible para que se produzca esa reacción, pero hay que tener en cuenta que por sí solo es un elemento cáustico muy peligroso, cuyo manejo implica tomar una serie de precauciones muy importantes para manipularlo con seguridad. Los álcalis más utilizados en la fabricación del jabón son la sosa (hidróxido sódico, NaOH) y la potasa (hidróxido potásico, KOH). Por eso, es necesario tener mucha experiencia y unos conocimientos muy amplios sobre los álcalis y sus reacciones químicas, para proceder a realizar una saponificación que ofrezca totales garantías de que el producto final obtenido no entrañe riesgo alguno para la piel.
Esto no significa que la saponificación sea un proceso terriblemente peligroso, sino más bien muy delicado de realizar: Así, por ejemplo, si en la reacción anterior hay un exceso de sosa, el producto resultante será una masa cáustica inservible; mientras que si por el contrario, la cantidad de sosa es insuficiente, el producto resultante será una mezcla grumosa de aceites, que en nada se parecerá tampoco al jabón. Es por eso que para realizar un buen jabón, perfectamente saponificado, y con unas excelentes cualidades limpiadoras y emolientes, aparte de una gran experiencia y conocimientos de la saponificación, se necesita conocer también una serie de tablas con parámetros y proporciones muy concretas de cada uno de los elementos que constituyen la reacción, así como su correcta formulación.
El conjunto de dichas tablas imprescindibles para la elaborar cualquier tipo de jabón, es lo que se conoce como tablas de saponificación:
0,134g Aceite de oliva 0,190g Aceite de coco
0,141g Aceite de palma 0,134g Aceite de girasol
0,128g Aceite de ricino 0,136g Aceite de almendras
0,133g Aceite de aguacate 0,135g Aceite de soja
0,136g Aceite de maíz 0,133g Aceite de sésamo
0,069g Aceite de joroba 0,156g Aceite de palmiste
0,132g Aceite de germen de trigo 0,069g Cera de abeja
0,137g Manteca de cacao 0,128g Manteca de karité
Forma de Uso:
Para saber cuánta sosa se necesita para saponificar una cantidad de una grasa concreta, sólo hay que multiplicar dicha cantidad por el valor correspondiente que aparece en la tabla. Por ejemplo, para saponificar totalmente 100g de aceite de oliva (en la tabla su parámetro es de 0,134) basta multiplicar 100 x 0,134 = 13,4g de sosa necesitaremos.
En el caso de que vayamos a hacer un jabón con diferentes aceites, habría que buscar la cantidad necesaria de sosa para cada tipo de aceite concreto, y luego sumarlas todas. También por eso, en las recetas de jabón, si queremos sustituir un aceite por otro, también habrá que ajustar la cantidad de sosa necesaria.


Buenas tardes, quisiera saber quimicamente como se determina el tiempo de la reacción de saponoficación? Porque se supone que debería terminar cuando se obtienen los productos. Y como determinaron esos indices? fue experimental o con la estequiométria de la reacción?
muy bueno.
se puede hacer jabon con aceite de motor de autos
Wow! muchas gracias por la explicación, más claro que el agua.
Paginas como estas salvan la vida
trankiolos a todos, que los ignorantes cuando no tienen nada que decir, solo hacen ruidos para llamar la atencion, por lo visto a este niños los papas no le ponian cuidado.
Cada aceite es diferente, unos son mas espesos que otros y ahí es donde varía el resultado, después de varios intentos y formulas, la mas acertada en lo personal es esta:
Por cada 100 gr. de aceite según la Tabla de Saponificación: ejemplo Aceite de Maíz, son 0.136 gr de Sosa Caustica, en si entre todos los aceites están entre 0.130 a .0137 en el caso del aceite de coco, son .190 gr. de Sosa.
También tiene que ver mucho la temperatura ambiental, es decir si hace frío o esta fresco el lugar, es mucho mejor que en un lugar caliente,
Gracias por la inforación! Es muy úitl..
buenas tardes, alguien ha obtenido productos finales, al saponificar la parafina liquida.
tenez razon
Que tal ? tu formula esta bien, solo te faltan 250gr. de soda. Osea que seria asi : 3 litros de agua, 750gr de soda y 3 litros de aceite
Tiene razón el comentario desubicado de arriba
ola muy buena información e sirvió mucho en esta ocasion
alguien me puede ayudar a calcularla cantidad de agua gracias … como se calcula
Hola buenas noches…Me alegra mucho que usted tenga tantas formulas y sepa hacer jabón ya que yo he sido el propio desastre con estas formulas…trate de hacer jabón y nunca se puso duro y menos se mezclo y eso que utilice una formula que varias personas dan en youtube…quisiera hacerle una pregunta?? yo hice la formula con aceite mineral el que también llaman parafina liquida y la formula fue : 3 litros de agua, 500 ml de sosa y 3 litros de aceite y no me dio esta formula…según su experiencia la cual respeto mucho..usted me puede ayudar a no perder esta materia prima…gracias de antemano
no existe algun informacion acerca del indice de saponificacion?
Hola gente, la verdad es muy fácil producir jabones artesanales lo digo de experiencia propia. Lo importante es estadio del curado. he creado varias formulas naturales. El próximo paso es sintetizarlas, lo cual es muy complicado conseguir materias primas.
trate con 3NaOH
Se que es un poco tarde, pero bueno, estaba buscando info para mi informe y vi esto…. Si lo quieren volver a itentar, tienen que tener en cuenta dos cosas, la primera es que la sosa (o soda caustica, que esta compuesta por NaOH) se disosia o iniza separando el Na por un lado y los Oh por otro, la efervescencia se debe a la reacción del Na con agua y se vuelve a producir NaOH. Segundo si al aceite le agregas la soda o sosa, no solo se forma jabon, sino también glicerol, el liquido es el glicerol y lo espeso jabon, por lo tanto una vez mezclado, deja solidificar y separa el liquido del solido. Un consejo es que al aceite viertan la sosa y luego viertan el agua. Es un tema de concentración , si hay mucha agua la sosa se disuelve mucho y el aceite flota en el agua y no reacciona completamente con la sosa y eso es lo importante la reacción entre la sosa y el aceite. Espero que les sirva.
genial, pero me gustaría que pongan la fuente, de igual forma gracias por la informacion
por qué es sosa y no soda caustica?
me gustaría saber en qué cantidad de agua se disuelve el hidróxido de sodio
Falta de respeto. Lo bueno es aportar al tema. Si no hay nada bueno que aportar pues no decir nada.
Saludos.
Tengo una pregunta: ¿si quiero hacer jabón liquido para lavar ropa, cómo lo puedo hacer?
Me gustaria saber si una vez hecho el jabon hay que esperar para que el efecto caustico de la sosa desaparezca, o sea saber si recien cuajado y cortado ya deja de quemar el jabon, o si hay que esperar un tiempo para usarlo
loko yo use manteca de cerdo y fíjate q la primera prueba salio pésima pero agregue mas sosa y menos agua y ahora hasta lavo mi ropa con el, talvez muxos fallan en las medidas pero eso no quiere
decir q se den por vencidos
Recuerda que cada elemento químico tiene un peso especifico, basta hacer la ecuación; pero por experiencia un litro de agua es casi un kilogramo, y no es el kilogramo porque depende de la temperatura a la que se encuentre el agua y la altura sobre el nivel del mar, pero como fines prácticos se relaciona un litro igual a un kilo, por lo tanto un ml igual a un gramo.
hola tengo la formula del jabon y elaboracion pero porque en algunas recetas me dan el agua en gramos osea que hay que pesarla
Falta como elaborarlo
A MI ME PASÓ LO MISMO QUE A PABLO , LLEVO 4 DIAS REVOLVIENDO Y CUANDO REPOSA , ME APARECE EL LÍQUIDO ABAJO Y ARRIBA ESPESO ???? ALGUIEN ME PUEDE AYUDAR ? …11 -2 – 14….GRACIAS!!!!!!!
Me gusto mucho. Gracias
MIUCHAS GRACIAS POR LA INFORMACION, ME SIRVIO PARA MI PROYECTO:')
me vale madres lo que hagas con los jabones solo se happy #YOLO
Perdonarme con las prisas se me olvidó decir la cantidad de agua. La mezcla es 180g de sosa con 1l de agua y1l de aceite.
Y cuanta agua??? Como se calcula la cantidad de agua????
Y como se calcula la cantidad de agua?????????
Muy buena tu informacion de echo un poco mas completa y a la vez resumida graciass esto me servira para mi proyecto de quimica suerte (y) ¡¡¡¡saludos desde Panamá!!!!
Crea un blog
muy útil esta información ! clara y precisa.
muy útil esta información, concisa y precisa.
creo que todo esta bien pero era necesario saber por que en la saponificacion la glicerina aparece en la fase acuosa…..
q ondaaaaaaaaaa voy a hacer jabones
Hola,yo suelo hacer jabon y siempre me ha salido estupendo hago la mezcla de 180gramos de sosa y 1 litro de aceite.antes lo mezclaba con un palo de madera pero esta ultima vez lo hice con una batidora de las que usan los pintores pues me dijeron que tambien se podia hacer con lo cual me salio igual y con menos esfuerzo.un saludo
no trae las aplicaciones industriales
Muy buena tu información me sirvió para mi proyecto:3
Muy Muy Valiosa tu informacion, me gustaria tener la tabla con el indice de mas productos (aceites)
gracias a esta informacion podre terminar mi presentacion para mi trabajo de quimica y se qahora tengo q poner a trabajar a mis amigas por que es un trabajo muy peligroso y soy muy joven y guapo como pàra morir
Hay un proceso para hacer jabón que se llama saponificación en frío. Respondiendo al comentario de Pablo, más arriba, ya he tenido experiencia en hacer jabón con el aceite que se recicla de la cocina. El procedimiento que he usado, y que me ha dado excelentes resultados, es el siguiente:
Se elabora una solución al 30% en masa de NaOH, y por cada 100g de aceite se usan 45g de dicha solución. Ambos líquidos deben estar entre 40 y 50°C ya que en principio la saponificación es un proceso lento que comienza justo después de que el estado de gel caliente que se obtiene al hacer la mezcla se enfríe y se endurezca. Esto se logra de una manera muy simple: con una batidora de mano. Se comienza a batir desde velocidad baja y se va aumentando progresivamente, hasta que se llegue al punto de "traza" que es cuando la consistencia es como la mayonesa, que le pasas una varilla de vidrio o un palito y queda el rastro. En este punto se añade el colorante y la esencia. La cantidad de estos es muy relativa, dependiendo del gusto personal. Luego se vierte en un molde y se deja endurecer. Al otro dia se puede desmoldar y cortar, pero hay que dejarlo curar entre 3 y 4 semanas.
¿Por qué? Esta barra (o barras) sólida realmente es el gel endurecido, pero no ha ocurrido la saponificación aún. Te das cuenta porque al medir el pH con una cinta universal te entre 12 y 13. Luego del tiempo señalado, el pH debe bajar hasta 8 para poder ser utilizado con seguridad, pero mientras tanto no se debe usar y debe manipularse con guantes. Es posible que el jabon exude un líquido viscoso, y este es la glicerina que se produce.
Ahora, el tipo de aceite que se usa determina muchas cosas, como el tiempo de saponificación, la espuma, el pH final, etc. Por ejemplo, el aceite de canola es muy buen limpiador pero no genera casi espuma, mientras que el aceite de coco produce un jabon bastante espumoso.
Debo hacer una observación importante: para hacer jabón NO se debe utilizar nada que sea metálico, a excepción del acero inoxidable que viene con los batidores, por ejemplo, y el molde debe ser de plástico o madera.
Espero sea de provecho 😉
Gracias por el bonito post. Voy a hacer el experimento en clase, ojalá no se me queme ningún niño. Por cierto, mi madre, cuando yo era pequeño, tenía un droguería y vendía el jabón que ella hacía en casa, lo hacía a ojo, con lo cual a veces le salía bien y otras no.
Y si quiero hacer un jabón con potasa? cómo le hago?
Saludos!
Hola! gracias por compartir el articulo, te cuento que hice el jabon con la misma receta pero, cuando puse la soda caustica en el balde con agua, hubo una reacción química muy suave, muy tímida, muy pequeña, el balde en vez de ponerse caliente se puso algo tibio, no llego a burbujear mucho. En fin, luego de mezclar 1 poco añadí el aceite y mezcle por 1 hora y 15 minutos hasta lograr una contextura algo cremosa. Lo deje reposar por 48 horas pero hoy me fije otra vez y el jabón esta liquido, blando, no se puede ni cortar. Me dio 1 poco de pena y no entiendo q pudo salir mal. Es posible q la sosa sea de mala calidad? ayuda calentar o hervir el agua o el aceite antes? la sal es realmente importante? te agradecería si me respondes estas preguntas pues lo quiero intentar otra vez, Abrazo desde Argentina! Paz!
ESta muy PAdre tu Publicaion
ES muY extensa y MUY buena
grasias esta muy bien echo a mi si me sirvio
esta muy bien eso
mmmm
pero no entendi no encuentro el tipo de reacciones quimicas que estan involucradas
Muy buena información, Gracias!
Me gustó su explicación se los agradezco mucho, gracias.
Fue muy enriquecedor.
ammmm una pregunta ezthe producto d kasualidad se utiliza el baño mariA ???
ESTA CHIDO
me parecio interesante, es lo que yo estava buscando. buen trebajo
graccias, espero sea una información verdadera….por que sino loes;tendre problemas
Excelente! se agradece mucho. =)
PerFectoo! muy buena informacion Exelente me servira para mi experimento ^^ Muchas gracias
PUES LO QUE FALTO ME PARECE FUE LAS ECUACIONES QUIMICAS DE LA REACCION PARA OBTENER EL JABON PERO ES IMPRESIONANTE
Está buena la información, concuerdo con Fernando, no estan la fuentes; y sugiero que se lo aborde desde un punto de vista más químico,osea más profundo,como es dibujo (esquema) que está genial, saludos, (es una crítica constructiva, no es para ofenderse)
buena info me sirvio de mucho gracias
Esta muy bien la tabla,
lo único que no se muestran
las fuentes consultadas.
son los jabones
vaya… me parecio muy enriquezedora tu informacion c:
gracias ^^
esto me servira para mi experimento de quimica